A maioria dos distúrbios das glândulas paratireóides é devido ao excesso de produção do hormônio paratireoideano (PTH) por uma ou mais glândulas paratireóides. Isto é chamado hiperparatireoidismo e causa um grande número de problemas médicos como: osteoporose, desordens mentais, úlceras, pancreatites, cálculos urinários e outros sintomas. No entanto, o aumento acentuado dos tecidos paratireoideanos responsáveis pela alta taxa de produção de paratormônio (PTH) não têm malignidade e por isso eles são usualmente denominados adenomas de paratireóides (tumores benignos secretores de paratormônio). Em outras palavras, o típico paciente portador de doença paratireoideana tem um tumor benigno em uma de suas glândulas paratireóides.
A doença paratireoideana é causada por uma única glândula paratireóide doente em 90% dos casos. Já que existem outras 3 glândulas paratireóides normais, a remoção de uma única glândula paratireóide doente é a medida mais simples para obter-se a cura.
As glândulas paratireóides não são diferentes dos outros tecidos do corpo humano - Elas podem apresentar câncer. O câncer da paratireóide, no entanto, é extremamente raro, com somente cerca de 12 casos por ano nos Estados Unidos da América. O câncer da paratireóide é tão raro que é comum a maioria dos médicos desconhecê-lo.
Muito raramente, a glândula paratireóide desenvolverá um câncer (o crescimento excessivo pode ser devido a células malignas). Um crescimento tumoral descontrolado da paratireóide proporcionará um aumento proporcional dos níveis de paratormônio (PTH). Dessa forma, isso pode ser um sinal de que um paciente com hiperparatireoidismo pode ter câncer de paratireóide, visto que esses tumores malignos produzirão níveis muito mais altos que os produzidos por tumores benignos de paratireóides (adenomas ou hiperplasia). Todos os paciente com hiperparatireoidismo têm elevados níveis sangüíneos de paratormônio. Aqueles com doença benigna tendem a ter níveis quantificados em "centenas", enquanto aqueles com câncer de paratireóide tendem a ter valores quantificados em "milhares".
RESUMO DO TRATAMENTO DO CÂNCER DE PARATIREÓIDE
Há tratamento para todos os pacientes com câncer de paratireóide. Dois tipos de tratamentos são utilizados: Cirurgia (remoção cirúrgica do câncer de paratireóide e qualquer tecido próximo que esteja comprometido) e Radioterapia (com altas doses de raios-x para destruir as células cancerosas). Quimioterapia (uso de medicamentos que matam células com câncer) está sendo empregada em alguns estudos clínicos, mas não têm sido identificados medicamentos eficazes até o momento.
Cirurgia é o mais comum e de longe o melhor tratamento para o câncer de paratireóide. O tratamento para o câncer de paratireóide depende do tamanho do tumor, sua localização, e sua difusão ou não para outros tecidos. A glândula paratireóide (paratireoidectomia) e a metade da tireóide do mesmo lado do câncer (lobectomia tireoideana) são removidas.
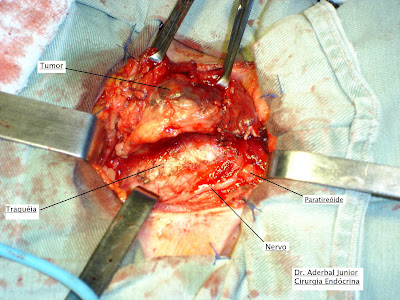
A foto no topo da página demonstra uma lobectomia tireoideana em que o câncer da paratireóide inferior esquerda foi encontrado infiltrando a glândula tireóide e a musculatura pré-tireoideana. O câncer é essa grande massa arredondada escura com a legenda: "Tumor". Pode-se ver também o nervo laríngeo recorrente esquerdo passando lateralmente à traquéia e a paratireóide superior esquerda que se encontra normal.
A retirada de uma amostra dos linfonodos regionais próximos ao tumor é realizada durante a cirurgia. A presença de aumento dos linfonodos indica a necessidade de linfadenectomia (remoção de todos os linfonodos naquela área do pescoço).
A Radioterapia utiliza-se de altas doses de Raios-X para destruir as células neoplásicas e pequenos tumores, mas quase nunca é utilizada para tratamento do câncer de paratireóide em fase inicial. Se o câncer de paratireóide recidiva após o tratamento ou se está infiltrando outras estruturas cervicais por ocasião da cirurgia, a radioterapia poderá ser empregada como adjuvante ao tratamento cirúrgico.
O Paratormônio deve ser medido anualmente por muitos anos para identificar-se a recidiva. Oncologistas e Endocrinologistas acompanham os níveis de paratormônio como um marcador tumoral após a cirurgia, visto que um aumento excessivo de seus níveis pode significar uma recidiva local ou à distância do tumor.
A Cirurgia Radio-guiada minimamente invasiva de paratireóide é indicada para esse tipo de câncer. Esse tipo de cirurgia tem sido altamente desenvolvida para o tratamento de outras doenças das paratireóides. O conceito é empregar-se um radiotraçador, ou seja uma substância radiativa que é absorvida pelas células hipercaptantes da paratireóide. O cirurgião durante a cirurgia utiliza-se de um detector de radiação (probe) do tamanho de uma caneta que emite sons os quais tornam-se cada vez mais altos à medida que o probe é aproximado do tecido marcado. Este método funciona muito bem para todos os pacientes com enfermidades das paratireóides, inclusive para aqueles com câncer de paratireóide.
A Cirurgia Radio-guiada de Paratireóide pode ser utilizada em re-operações. Se os níveis de paratormônio no pós-operatório tardio (alguns meses ou vários anos após) indicam que há recidiva tumoral (loco-regional ou à distância em outros órgãos do corpo), então a Cintilografia com Sestamibi demonstrará onde o tumor está localizado, e a cirurgia radio-guiada de paratireóide poderá ser realizada. Uma vez mais, a radiatividade das células tumorais da paratireóide poderá ser demonstrada com o probe, e o cirurgião pode localizar e remover o tecido neoplásico. Essa técnica é muito mais precisa, e muito menos invasiva que a operação "padrão" de paratireóide.
DR. Aderbal Júnior (cirurgiao endocrino)
Câncer da Paratireóide
Por Roberta Mendes às 10:32:00 0 tireóides "falaram"
Marcadores: Cirurgia, Doença Relacionada à Tireóide, Tumores
Formulas para emagrecer podem causar problemas à Tireóide
O tempo esquenta e a chegada do verão anuncia menos roupa, ameaçando pôr em evidência as gordurinhas amealhadas no inverno.
Essa equação já basta para que muita gente recorra a fórmulas mágicas que prometem derreter o excesso de peso. E é aí que mora o perigo, revela pesquisa divulgada no Congresso Mundial de Tireóide, realizado em Buenos Aires (Argentina).
Pelo estudo, que avaliou 1.292 mulheres a partir dos 35 anos no Rio de Janeiro, 34% das entrevistadas já haviam usado alguma fórmula manipulada para emagrecer, 12% delas nos dois meses anteriores. Embora altos, os índices não chegaram a surpreender os pesquisadores.
O que chamou a atenção foi que o levantamento revelou mais de 80 substâncias diferentes usadas nas fórmulas para emagrecer, entre elas o triac (ácido triiodotiroácetico ou tiratricol) e o hormônio T3, que suprimem o TSH (hormônio da tireóide) e causam hipertiroidismo (veja quadro), uma disfunção da glândula tireóide.
“Acho que as mulheres não têm a menor idéia do que estão tomando e, mesmo que tivessem, a maioria ainda correria o risco, por vaidade”, acredita o endocrinologista Mário Vaisman, da Universidade Federal do Rio de Janeiro, que conduziu a pesquisa com a epidemiologista Rosely Sichieri, da Universidade Estadual do Rio de Janeiro, sob o patrocínio dos laboratório Abbott.
A pesquisa mostrou que o risco de desenvolver o hipertireoidismo era duas vezes maior nas mulheres que tomavam fórmulas para emagrecer (veja quadro). Ainda que os sintomas desaparecessem quatro semanas após a interrupção do tratamento, os médicos chamam a atenção para os riscos de doenças cardíacas em mulheres acima dos 40 ou 50 anos.“Os riscos aumentam mais à medida que idade avança; por isso é assustador que mulheres na faixa dos 50, 60 e 70 anos estejam engrossando essa lista”, diz Mário Vaisman. O próximo passo, segundo os pesquisadores, é descobrir que tipo de danos permanentes podem ocorrer com o uso prolongado –mesmo que interrompido por alguns meses.
O endocrinologista Marcio Mancini, da Universidade de São Paulo e da Abeso (Associação Brasileira de Estudos da Obesidade), conta que já atendeu uma paciente que vinha com um “histórico” de 30 anos de fórmulas para emagrecer. “Ela tomava por seis meses e parava outros seis meses. Infelizmente, gente assim não é exceção”, lamenta.
Truque
O maior problema é a falta de critério na hora de receitar. “Infelizmente, há colegas que não pedem exames complementares e emitem receitas misturando um número sem fim de componentes. Já vi formulações com 15, 20, 30 coisas diferentes”, diz Mancini.
Em geral, as fórmulas agregam substâncias para reduzir o apetite, ativar o funcionamento da tireóide, aumentar a saciedade, laxantes, diuréticos, ansiolíticos (para diminuir a ansiedade) e antidepressivos, entre outros. Para driblar a Anvisa (Agência Nacional de Vigilância Sanitária), que proibiu a associação de medicamentos em uma única cápsula, muitos médicos desdobram a fórmula em três ou quatro receitas diferentes.
Antes de conhecer os resultados da pesquisa do Rio de Janeiro, a Abeso já havia publicado um manifesto recomendando que os hormônios tiroidianos e de triac fossem proibidos nas farmácias de manipulação, uma vez que as marcas comerciais existentes são suficientes para a população que realmente necessita.
Até porque, segundo Mancini, incluir hormônio para ativar a tireóide é, além de tudo, uma falta de conhecimento. “Ninguém é obeso por causa da tireóide. Quem tem realmente o problema ganha, no máximo, 5 kg e aí, sim, controla com tratamento.” Um dos grandes problemas do uso prolongado de fórmulas para emagrecer que incluem hormônio da tireóide é que pode haver uma perda óssea muito maior do que a normal. Além disso, sua associação com inibidores de apetite provocam aumento da ocorrência de taquicardia e arritmias. O estudo apresentado em Buenos Aires tinha, na verdade, como principal finalidade fazer um levantamento epidemiológico sobre hipotiroidismo na população feminina brasileira. Mais de 12% das mulheres acima dos 35 anos têm a doença e cerca de 85% não sabiam, números preocupantes segundo os coordenadores da pesquisa. O resultado, de acordo com os médicos, mostra a necessidade de uma política de saúde pública em relação à tiróide. “Atualmente, não há nenhum tipo de recomendação de exame periódico, como nos EUA, por exemplo, onde as mulheres são aconselhadas a fazer testes a cada cinco anos depois dos 35”, compara Mário Vaisman.
Com uma medida dessas, diz Vaisman, o hipotiroidismo seria diagnosticado precocemente e controlado, já que o tratamento não adequado pode trazer sérios problemas ao cérebro, ao aparelho reprodutor e à estrutura óssea.
Revista da Folha - 6 de Novembro de 2005
Por Tireóide às 18:09:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Síndrome do Túnel do Carpo
 Síndrome do túnel do carpo é uma neuropatia resultante da compressão do nervo mediano no canal do carpo, estrutura anatômica que se localiza entre a mão e o antebraço. Através desse túnel rígido, além do nervo mediano, passam os tendões flexores que são revestidos pelo tecido sinovial. Qualquer situação que aumente a pressão dentro do canal provoca compressão do nervo mediano e a síndrome do túnel do carpo.
Síndrome do túnel do carpo é uma neuropatia resultante da compressão do nervo mediano no canal do carpo, estrutura anatômica que se localiza entre a mão e o antebraço. Através desse túnel rígido, além do nervo mediano, passam os tendões flexores que são revestidos pelo tecido sinovial. Qualquer situação que aumente a pressão dentro do canal provoca compressão do nervo mediano e a síndrome do túnel do carpo.
Causas
A causa principal da síndrome do túnel do carpo é a L.E.R. (Lesão do Esforço Repetitivo), gerada por movimentos repetitivos como digitar ou tocar instrumentos musicais. Existem também causas traumáticas (quedas e fraturas), inflamatórias (artrite reumatóide), hormonais e medicamentosas. Tumores também estão entre as possíveis causas da síndrome.
Sintomas
O principal sintoma é a parestesia, uma sensação de formigamento, de dormência, que se manifesta mais à noite e ocorre fundamentalmente na área de enervação do nervo mediano.
A evolução da síndrome dificulta manipular estruturas pequenas e executar tarefas simples como pregar um botão, enfiar uma agulha, segurar uma xícara.
Diagnóstico
Dois testes ajudam a estabelecer o diagnóstico: o teste de Phalen e o teste de Tinel.
O primeiro consiste em dobrar o punho e mantê-lo fletido durante um minuto. Como essa posição aumenta a pressão intracarpeana, se houver compressão do nervo, os sintomas pioram.
O teste de Tinel consiste em percutir o nervo mediano. Se ele estiver comprometido, a sensação será de choque e formigamento.
Em alguns casos, é necessário pedir uma eletroneuromiografia para fechar o diagnóstico.
Tratamento
O tratamento leva em conta o grau de comprometimento da doença. Se for leve, indica-se a colocação de uma órtese para imobilizar o pulso e o uso de antiinflamatório não-hormonal. Se não houver melhora, aplica-se cortisona dentro do canal do carpo.
Esgotadas as possibilidades de tratamento clínico, é indicada a cirurgia.
Recomendações
· Tente evitar atividades que impliquem movimentos de flexo-extensão do punho;
· Lembre-se de que alterações dos hormônios da tireóide e doenças como diabetes podem acarretar neuropatias compressivas. Procure o médico se tiver sensação de formigamento nas mãos;
· Mulheres no climatério estão mais sujeitas à síndrome do túnel do carpo, por causa da queda na produção de estrógeno;
· Sente-se corretamente e apóie braços e punhos quando usar o computador. Não se esqueça de que seu uso inadequado é um fator de risco para L.E.R. e a síndrome do túnel do carpo.
Por Tireóide às 14:28:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Tireóide também deve ser tratada com oftalmologista
Não é prática comum. Mas o ideal seria que os portadores de alterações hormonais fizessem um acompanhamento da tireóide com avaliações de um endocrinologista e de um oftalmologista. Chama-se Doença de Graves a manifestação das alterações tireoidianas nos olhos e sua evolução pode levar a perdas significativas de quantidade e qualidade de visão e até mesmo à cegueira.
De acordo com a oftalmologista, Patrícia Moitinho, especialista em cirurgia plástica ocular do Hospital Oftalmológico de Brasília (HOB), mulheres entre 40 e 50 anos de idade e fumantes são os principais alvos desta alteração que é percebida pelo aspecto de olhos saltados e pálpebras retraídas. “A Doença de Graves não é rara e a proporção é de oito mulheres para cada homem que a enfrenta”, compara a médica. Também são manifestações da Doença de Graves olhos vermelhos, irritados, semelhantes a uma conjuntivite, quando estão na fase inflamatória. A alteração se manifesta principalmente em pacientes com hipertiroidismo, aqueles em que há aumento de hormônios tireoidianos, mas também pode ocorrer em pacientes sem alterações hormonais esses respondem em até 20% dos casos.
Patrícia explica que a alteração hormonal da tireóide libera substâncias que levam os músculos extra-oculares a se espessarem e a gordura a inchar .Essa situação pode levar a compressão do nervo óptico, comprometendo a visão e é o que provoca a aparência de olho saltado, relata.
Os olhos empurrados para fora por uma hipertrofia dos músculos que os envolvem, podem levar ao risco de apresentarem inflamações corneanas e até úlcera de córnea, alerta a médica. O estrabismo também pode ser provocado por alterar os músculos extra- oculares.
Tratamento - O tratamento da Doença de Graves é longo e exige do portador de alterações hormonais um acompanhamento permanente. Segundo a médica do HOB, ao chegar ao oftalmologista, o paciente será instruído a realizar alguns exames. Uma tomografia de órbita, em uma clínica de radiologia. Este exame irá mostrar as condições do músculo extra-ocular, do nervo óptico e da gordura. Também será solicitado um exame de dosagem hormonal de T3, T4 livre, TSH.e anticorpos antitireoidianos. Outro exame, este realizado em clínicas oftalmológicas, é o de campo visual, para avaliar alterações no campo de visão.
Patrícia diz que a manutenção dos hormônios em níveis normais já leva o paciente a uma melhora. O tratamento com corticóides pode ser necessário e, eventualmente, a situação exige um procedimento cirúrgico.
Tireóide – A tireóide é uma pequena glândula com formato de borboleta que se situa na região anterior do pescoço e desempenha o papel fundamental de controlar o metabolismo de todo o organismo humano. A tireóide produz hormônios importantes na regulação corporal.
Graves – a Doença de Graves recebe este nome em homenagem ao médico Robert Graves que a descreveu em 1835. Ele identificou a anomalia como uma doença auto-imune, que gera alterações no funcionamento das glândulas tireóides e apresenta irritação nos olhos e nas pálpebras.
Hipotireoidismo Congênito
De acordo com Brasil (2002), Hipotireoidismo Congênito ocorre quando a glândula tireóide do recém-nascido (RN) não é capaz de produzir quantidades adequadas de hormônios tireoidianos, o que resulta numa redução generalizada dos processos metabólicos.
A patologia pode ser classificada em:
• Primária – quando a falha ocorre na glândula tireóide;
• Secundária – quando ocorre deficiência do TSH hipofisário;
• Terciária – quando ocorre deficiência do TRH hipotalâmico;
• Resistência periférica à ação dos hormônios tireóideos.
Em regiões onde a deficiência de iodo não é endêmica, o Hipotiroidismo Congênito é mais freqüentemente causado pela glândula tireóide ausente ou ectópica (Hipotiroidismo Primário), de etiologia esporádica. Mais raramente, em cerca de 15% dos casos, é uma patologia herdada recessivamente, levando a uma falha na biossíntese do hormônio tireoidiano.
Em crianças não submetidas a programas de Triagem Neonatal e, conseqüentemente, não tratadas precocemente, o crescimento e o desenvolvimento mental ficam seriamente comprometidos. As manifestações clínicas são: hipotonia muscular, dificuldades respiratórias, cianose, icterícia prolongada, constipação, bradicardia, anemia, sonolência excessiva, livedo reticularis, choro rouco, hérnia umbilical, alargamento de fontanelas, mixedema, sopro cardíaco, dificuldade na alimentação com deficiente crescimento pôndero-estatural, atraso na dentição, retardo na maturação óssea, pele seca e sem elasticidade, atraso de desenvolvimento neuropsicomotor e retardo mental.
As crianças que realizam diagnóstico precoce através dos programas de Triagem Neonatal não apresentam qualquer sintomatologia clínica, desde que a terapia de reposição hormonal seja iniciada precocemente.
O momento ideal para o diagnóstico do Hipotireoidismo Congênito é o período neonatal, pois se sabe que a partir de 4 semanas de vida, a deficiência de hormônios tireóideos já pode causar alguma lesão neurológica.
A triagem pode perder raros casos de Hipotireoidismo Congênito, tais como Hipotireoidismo Pituitário Hipotalâmico, doença compensada (T4 normal, TSH elevado) ou aumento de TSH tardio, que são muito raros ( talvez 2 a 3 por 100.000).
Sempre deve ser realizada a dosagem de T4 (T4 total e T4 livre) e TSH em amostra de sangue venoso, obtida o mais cedo possível após os resultados positivos iniciais no Programa de Triagem Neonatal, para que haja a confirmação diagnóstica. Agindo dessa forma, a média de detecção dos casos suspeitos é de aproximadamente 90%. Os 10% dos casos restantes são menos severamente afetados e não se tornam detectáveis por TSH até a idade de 2 a 6 semanas.
Para que seja determinada a etiologia do processo, como na maioria das vezes (85%), a origem é na própria glândula tireóide, existe a indicação de realizar exames de ultrassonografia da tireóide ou cintilografia com captação tireóidea de iodo radioativo. Quando a espera para a feitura desses exames puder vir a retardar o início da terapia de reposição hormonal, os mesmos serão deixados para serem realizados somente após os 2 anos de vida da criança, quando poderemos suspender a medicação para sua realização. Nos casos mais raros de etiologia secundária ou terciária, indicam-se também os testes laboratoriais com estímulo de TRH.
Tratamento
O tratamento da patologia consiste na reposição dos hormônios tireóideos deficitários, no caso, reposição de Levotiroxina. A Levotiroxina Sódica é o sal sódico do isômero sintético da Tiroxina (T4), sendo que sua utilização para reposição hormonal produz a normalização do estado metabólico que se encontra deficiente no Hipotiroidismo. No meio intracelular, T4 é convertido em T3, dessa forma disponibiliza-se ambos os hormônios tireóideos, mesmo administrando somente um deles. O tratamento preconizado deverá ser mantido por toda a vida.
A Levotiroxina é apresentada na forma de comprimidos que contém 25 a 300 µg, e na forma de pó para reconstituição para uso em injeções, sendo que a dose utilizada varia de acordo com a idade do paciente e seu peso corporal, sendo que as crianças mais jovens necessitam doses superiores às crianças maiores e aos adultos. Inicia-se calculando doses de 10 a 15 µg/Kg/dia, para o RN a termo, após isso, a dose é recalculada conforme o ganho ponderal da criança e os níveis de T4 e TSH observados nos controles laboratoriais subseqüentes.
A meia-vida da Levotiroxina é de sete dias, sendo então administrada somente uma vez ao dia. Apresenta boa absorção via oral, havendo raramente a necessidade de sua utilização por via parenteral (neste caso, utiliza-se 75 a 80% da dose preconizada via oral).
Por Tireóide às 13:23:00
Marcadores: Doença Relacionada à Tireóide
Citopatologia Aspirativa
Citopatologia das Efusões e Líquidos
Abrange exame citopatológico de líquidos provenientes de cavidade pleural, cavidade abdominal ou cavidade pericárdica, ou seja, os derrames e a ascite. Incluem-se também os derrames articulares.
A coleta é realizada pelo médico assistente, que remove o líquido indevidamente acumulado. O material coletado deve ser armazenado em recipiente, imediatamente refrigerado, mas não congelado. É optativo o uso de anticoagulante, que quando utilizado, deve ser a heparina. A elaboração de cell blocks, em casos de líquidos, é sempre indicada para minorar a grande dispersão celular. Recomenda-se, nesses casos, que a requisição médica contenha os dados principais do paciente, a história clínica relevante, além da solicitação de exame citopatológico (pesquisa de células neoplásicas) e do cell block.
O laudo é descritivo, definindo se a amostra é ou não satisfatória, qualitativa e quantitativamente. Valorizam-se os elementos celulares inflamatórios e não-inflamatórios, distinguindo-se os transudatos e os exsudatos, nesse caso especificando-se o elemento predominante e pesquisando-se a presença de células malignas.
Citopatologia do Liquor
Método complementar na avaliação neurológica.
A coleta do material deve ser realizada pelo médico que assiste o paciente, por meio de punção, mais freqüentemente lombar. O material aspirado, invariavelmente escasso, deve ser imediatamente enviado para o laboratório. Esse procedimento não deve demorar mais do que 1 hora, permitindo que seja processado o mais rápido possível.
O laudo é descritivo, identificando-se: hemorragias, meningites bacterianas e virais, infecções por fungos (Cryptococcus neoformans, blastomicose, histosplasmose), toxoplasmose, neoplasias primárias do sistema nervoso central (meduloblastoma, gliomas, astrocitoma, oligodendroglioma, ependimoma, tumores do plexo coróide e da crista neural), tumores hipofisários, linfomas, leucemias, meningioma (raramente diagnosticado pela citopatologia), tu mores metastáticos (primários do pulmão, mama, estômago, melanoma).
Citopatologia Aspirativa de Lesões e Órgãos
Possui sinonímias, como biópsia aspirativa de agulha fina, punção biópsia aspirativa de agulha fina e punção aspirativa de agulha fina. Devido a tal variedade de terminologias, esse exame citopatológico é, com freqüência, solicitado erroneamente como histopatológico. Sua aplicação teve início por volta de 1930, adquirindo, a partir de então, cada vez mais espaço nas investigações clínicas. É considerada uma técnica diagnóstica que, em casos de cistos, pode ser também terapêutica.
A punção aspirativa de agulha fina (PAAF) pode ser executada em consultórios ou em pacientes acamados em seus domicílios, não necessitando de internação hospitalar. É, portanto, menos onerosa, mais rápida e menos estressante. Considerada inócua, tanto que alguns autores atuais a apelidam de S.A.F.E. (Simple, Accurate, Fast, Economic), é o método de maior segurança para a obtenção de um diagnóstico morfológico. Possui sensibilidade e especificidade altas, com raros resultados falso-positivos. Substitui ou complementa as biópsias de congelação, amenizando o estresse intra-operatório diante de um diagnóstico e viabilizando o assentimento do paciente para uma terapêutica cirúrgica imediata mais radical.
A PAAF evita cicatrizes, que não constituem somente um problema estético, pois podem dificultar diagnósticos de imagem, como por exemplo a mamografia.
Especialmente indicada na investigação de lesões parenquima-tosas, nodulares, císticas, de localização superficial, acessíveis por punção, a PAAF igualmente apóia a investigação clínica de lesões viscerais mais profundas, desde que orientadas, simultaneamente, por diagnóstico de imagem.
As contra-indicações são restritas ao quadro clínico do paciente, e não propriamente a esse método diagnóstico em si. Deve-se evitar, por exemplo, uma punção prostática em pacientes com prostatite, assim como se evita uma punção tireoidiana em pacientes com tosse.
É raríssima a ocorrência de complicações decorrentes de uma punção de agulha fina. A freqüência de implantação tumoral do trajeto da agulha é menor que a provocada pelas core-biópsias, e, quando acontece, isso não altera o quadro clínico, a evolução da patologia nem seu prognóstico. Recomenda-se a punção com agulhas de menor calibre, cujo comprimento dependerá da profundidade da lesão a ser puncionada.
Chamamos a atenção para o fato de que o tamanho da agulha não é proporcional à qualidade da amostra. Ou seja, agulhas de maior calibre não significam melhor qualidade do material.
Na necessária e bem-vinda interação clínico-patológica, não deve haver constrangimento nem deve se considerar inabilidade de alguma das partes caso o material não se mostre absolutamente adequado para diagnóstico.
Medidas terapêuticas radicais não devem basear-se em achados citopatológicos somente, mas também nos quadros clínico, radiológico e histopatológico.
Não é necessário listar os sítios corporais passíveis de serem submetidos à punção aspirativa de agulha fina, uma vez que, como já citado anteriormente, essa pode ser aplicada a qualquer topografia onde a punção seja indicada para apoiar o diagnóstico.
Técnica da Punção Aspirativa por Agulha Fina (PAAF)
A agulha é introduzida na lesão com a seringa em posição de repouso. O êmbolo da seringa é retraído, provocando a sucção na agulha. Com movimento de vaivém, mantendo-se o êmbolo tracionado, movimentar a agulha em diversas direções (tipo chuveiro). Para evitar a sucção do material puncionado para o interior da seringa, recolocar o êmbolo da seringa novamente na posição inicial ou de repouso. Retirar a agulha da lesão.
Transferência do Material da Agulha para a Lâmina
A agulha contendo o material puncionado é desconectada da seringa. A seringa é preenchida por ar, tracionando-se o êmbolo. A agulha é conectada à seringa novamente com o êmbolo tracionado. O aspirado é expelido na lâmina, previamente identificada com as iniciais do paciente.
Preparação do Esfregaço
O esfregaço do material semi-sólido puncionado é elaborado com a ajuda de outra lâmina colocada perpendicularmente, que é deslizada sobre a primeira. O esfregaço de material líquido é ela borado por meio do deslizamento da extremidade de outra lâmina, colocada obliquamente, como nos esfregaços hematológicos. Quando o material puncionado possui fragmentos de tecido, espalha-se o material com a ajuda de outra lâmina ou processa-se, como cell block. As lâminas identificadas devem ser imediatamente submersas no fixador.
Para o máximo aproveitamento do material puncionado, aspira-se uma pequena quantidade de soro fisiológico e, após agitar, coleta-se o lavado da agulha e seringa em recipiente, que deve ser imediatamente refrigerado, para elaboração do cell block.
As lâminas e o lavado do material puncionado devem ser entregues ao laboratório o mais rápido possível, não ultrapassando 3 horas desde a coleta até a entrada no laboratório. Devem ser acompanhados de requisição médica que contenha os dados principais do paciente e da história clínica, como idade, macroscopia e evolução da lesão. No pedido, requisita-se exame de punção aspirativa, e, no caso de haver lavado da agulha ou se o material é líquido, também a requisição do exame histopatológico especificando cell block.
Paratireóide
A maioria dos indivíduos possui dois pares de glândulas paratireóides, localizadas posteriormente aos pólos superior e inferior da glândula tireóide. Elas são responsáveis pela secreção do hormônio paratireoidiano (PTH), que, posteriormente, é degradado nos tecidos periféricos, especialmente fígado e rins, produzindo os fragmentos aminoterminal e carboxiterminal. O fragmento aminoterminal tem uma meia-vida mais curta do que o carboxiterminal. Contudo, apenas a molécula intacta e o fragmento aminoterminal possuem atividade biológica.
A síntese e a liberação do PTH dependem dos níveis de cálcio ionizado: a hipercalcemia bloqueia e a hipocalcemia aumenta a secreção de PTH. A hipocalcemia prolongada da insuficiência renal crônica acarreta um hiperparatireoidismo secundário.
O PTH promove a conversão de 25-hidroxivitamina D (25-OHD) em 1,25-diidroxivitamina D (1,25-diidroxicolecalciferol). Nos rins, o metabólito diidroxivitamina D estimula diretamente a captação intestinal de cálcio.
O PTH também promove a liberação de cálcio do osso, além de aumentar a reabsorção e diminuir a excreção renal de cálcio. Promove ainda a excreção de AMP cíclico, hidroxiprolina, sódio, potássio e bicarbonato, além de inibir a reabsorção de fosfato, aumentando a fosfatúria.
O aumento dos níveis séricos de PTH causa manifestações clínicas de hipercalcemia. Casos leves necessitam de monitoração laboratorial periódica, tanto sérica quanto urinária. Casos graves representam emergência endocrinológica, com risco de vida, necessitando de intervenção médica imediata. A secreção inadequada de PTH causa hipocalcemia, cujo diagnóstico e tratamento precoce também são vitais.
Hiperparatireoidismo
O hiperparatireoidismo (HPT) pode ser classificado como primário, secundário ou terciário. O HPT primário caracteriza-se por aumento de PTH, hipercalcemia, hipofosfatemia e hipercalciúria, e pode ser causado por hiperplasias, adenoma ou carcinoma das paratireóides.
O HPT secundário decorre geralmente de insuficiência renal crônica ou deficiência de vitamina D (por deficiência na ingestão ou resistência à sua ação), que, devido à hipocalcemia prolongada, gera um aumento compensatório do PTH. Laboratorialmente, os achados mais clássicos são hipocalcemia, hiperfosfatemia e aumento do PTH.
O HPT terciário surge em decorrência de um período prolongado de HPT secundário com o desenvolvimento de autonomia na secreção de PTH e conseqüente hipercalcemia.
No pseudo-hipoparatireoidismo, os baixos níveis de cálcio sérico disparam a secreção de PTH. Contudo, nem os rins nem os ossos respondem ao estímulo, devido a defeito nos receptores hormonais, resultando em hipocalcemia persistente, apesar do aumento de PTH.
O PTHrP (PTH-proteína relacionada) é uma molécula semelhante à fração aminoterminal do PTH. É secretada por tecidos neoplásicos, como o carcinoma de células escamosas do pulmão, gerando um pseudo-hiperparatireoidismo, com hipercalcemia grave e níveis baixos ou indetectáveis de PTH.
Níveis de PTH elevados também ocorrem em 80 a 90% dos pacientes com a síndrome de neoplasia endócrina múltipla familiar tipo I (MENS tipo I), em indivíduos que apresentam adenoma ou hiperplasia das paratireóides associados a tumores hipofisários e pancreáticos.
As manifestações clínicas de hipercalcemia são variadas e afetam principalmente o sistema nervoso central, os rins, o coração e o trato gastrointestinal. São comuns manifestações como depressão, alucinações, coma, diminuição da filtração glomerular, poliúria, nictúria, polidipsia, nefrolitíase, fadiga, anorexia, náuseas, dor abdominal, constipação e úlcera péptica, O aumento de enzimas pancreáticas pode levar à pancreatite. Podem ocorrer também dores ósseas, fraturas, osteíte fibrosa cística e precipitação de cálcio em tecidos moles como pulmões, rins, vasos sangüíneos, articulações e córnea.
Hipoparatireoidismo
Após cirurgias de adenoma ou hiperplasia de paratireóide, em pacientes com doença óssea avançada, podem ocorrer hipocalcemia severa e tetania. É o chamado fenômeno do osso faminto, decorrente da rápida mineralização óssea e conseqüente depleção do cálcio ionizado circulante. Essa condição é geralmente transitória.
Inúmeras drogas usadas em quimioterapia podem alterar a função das paratireóides, acarretando hipocalcemia, hipomagnesemia e diminuição do PTH.
O hipoparatireoidismo primário definitivo pode seguir-se à remoção cirúrgica das paratireóides ou à auto-imunidade.
A síndrome de Di George é uma patologia congênita rara, que cursa com deficiência de PTH, devido à aplasia das paratireóides e do timo. Geralmente, a deficiência neonatal de PTH provoca a morte por hipocalcemia grave e infecções persistentes.
O hipoparatireoidismo funcional com hipocalcemia é observado com freqüência em crianças, especialmente pré-termo e de baixo peso ao nascimento. Isso é atribuído a uma imaturidade temporária ou à não-responsividade das glândulas paratireóides aos baixos níveis de cálcio por várias horas após o nascimento.
A secreção fetal de PTH pode ser inibida in utero em resposta à hipercalcemia materna.
O termo pseudo-hipoparatireoidismo é utilizado para casos de resistência à ação do PTH nos tecidos alvos, cursando com hipocalcemia, hiperfosfatemia e hiperplasia de paratireóides. Clinicamente, caracteriza-se por baixa estatura, obesidade, face redonda e 4o e 5o metacarpianos curtos. Essa síndrome é conhecida como osteodistrofia hereditária de Albright.
O hipoparatireoidismo idiopático abrange inúmeras desordens. O início da doença pode ocorrer na infância precoce ou mais tardiamente. Embora tenha sido relatada a presença de anticorpos circulantes, a etiologia ainda não está claramente definida.
Ocorrem ainda defeitos de liberação e de atividade do PTH, devido a vários outros fatores, como a diminuição de magnésio sérico, que impede a liberação do PTH e diminui seu efeito hipercalcêmico. Pacientes desnutridos como os alcoólatras têm tendência a hipomagnesemia.
As manifestações clínicas dependerão da intensidade e da duração da hipocalcemia. A hipocalcemia crônica pode ser assintomática, desenvolver sintomas precocemente ou apresentar doenças dermatológicas, como monilíase e psoríase. Os sintomas encontrados mais freqüentemente são irritabilidade neuromuscular, tetania, fraqueza muscular, laringoespasmo, broncoespasmo, manifestações psiquiátricas (ansiedade, irritabilidade e demência), arritmias, hipotensão, insuficiência cardíaca congestiva, catarata, fadiga, dores ou espasmos musculares. São comuns calcificações ectópicas.
Paratormônio (PTH) - Molécula Intacta
É útil no diagnóstico diferencial das hipercalcemias: hiperparatireoidismo primário, hiperparatireoidismo secundário (na insuficiência renal crônica) e hipercalcemias das doenças malignas. A dosagem de PTH deve ser incluída na rotina de investigação de litíase renal, devido à possibilidade de diagnosticar hiperparatireoidismo.
No hipoparatireoidismo, os níveis de cálcio encontram-se baixos, com PTH em níveis baixos ou indetectáveis. O hipoparatireoidismo transitório ou permanente pode ocorrer no pós-operatório de cirurgias da tireóide.
PTH-RP (Paratormônio - Proteína Relacionada)
É secretado principalmente por tumores malignos. O PTH-rp tem uma estrutura semelhante ao PTH e é útil no diagnóstico diferencial do hiperparatireoidismo primário e das hipercalcemias malignas. Não se eleva na insuficiência renal crônica.
Osteocalcina
A osteocalcina é uma proteína sintetizada pelos osteoblastos. É encontrada na matriz óssea, no tecido dentário e no sangue. Como sua função se relaciona à ligação do cálcio à matriz óssea, é utilizada como um marcador bioquímico da formação óssea. Sua concentração sérica reflete a atividade dos osteoblastos maduros e representa uma pequena percentagem da parcela sintetizada pelos osteoblastos, uma vez que a maior parte dessa fração está ligada à hidroxiapatita na matriz óssea.
Os níveis séricos variam de acordo com o sexo, a idade e o horário de coleta da amostra. Concentrações elevadas são encontra das na infância e na puberdade, com pico durante o estirão da puberdade e declínio na fase adulta. Nas mulheres após a menopausa, os níveis séricos tendem a se elevar.
A dosagem da osteocalcina está indicada na investigação das doenças ósseas, como osteoporose pós-menopausa, hiperparatireoidismo e doença de Paget, que cursam com níveis elevados. Também se encontra aumentada em pacientes com fraturas que necessitem de redução aberta, com inserção de pinos e nos casos de metástases ósseas não-tratadas. Níveis diminuídos são encontrados em pacientes em uso crônico de glicocorticóides, na osteoporose senil e no hiperparatireoidismo.
A reconhecida variação dos níveis de osteocalcina, relacionada à instabilidade após a coleta, determina cuidados especiais na coleta e no armazenamento das amostras.
AMPc
A maior parte do AMPc encontrado na urina provém da ação do paratormônio (PTH) nos túbulos renais. A dosagem é importante para o diagnóstico do hiperparatireoidismo primário. Atenção especial deve ser dada à possibilidade de resultados falso-positivos em pacientes com hipercalcemia tumoral, pelo estímulo realizado pelo peptídeo PTH-rp. Portanto, no diagnóstico diferencial de hipercalcemia, sua dosagem tem muito pouco interesse.
Por Tireóide às 13:12:00
Marcadores: Anatomia, Glândula, Paratireoide
Anticorpos Antitireoideanos
As doenças tireoidianas de etiologia auto-imune são acompanhadas da presença de auto-anticorpos. Sua determinação está indicada na investigação diagnóstica das tireoidites auto-imunes, principalmente doença de Hashimoto, doença de Graves, tireoidite pós-parto e mixedema idiopático.
Na investigação diagnóstica, recomenda-se a utilização da pesquisa associada de mais de um anticorpo para avaliar, dessa forma, a presença de anticorpos contra os diferentes antígenos. Os anticorpos mais pesquisados são antitireoperoxidase (anti-TPO), antitireoglobulina (anti-TIREO) e os anticorpos anti-receptores de TSH (TRAB).
Os anticorpos antimicrossomais foram por muito tempo, em associação com as dosagens dos hormônios tireoidianos, considerados o padrão para o diagnóstico das tireoidites auto-imunes. Hoje, podem ser substituídos pela pesquisa dos anticorpos antiperoxidase tireoidiana. A tireoperoxidase (TPO), principal enzima envolvida no procedimento de síntese de hormônio da tireóide, é uma glicoproteína, expressa apenas em células foliculares da tireóide. Ela é o principal antígeno na partícula microssomal da tireóide.
Os anticorpos antitireoperoxidase estão presentes em 4 a 9% dos adultos normais, em 57-74% dos pacientes com doença de Graves, em 99-100% dos pacientes com doença de Hashimoto ou mixedema idiopático, em 19% dos casos de tumores diferenciados de tireóide e, raramente, em pacientes com tireoidite subaguda. A prevalência de positividade em pacientes idosos (80 anos) é mais alta nas mulheres (10%) comparadas aos homens (2%).
Os anticorpos antitireoglobulina estão presentes em títulos elevados em cerca de 25% dos casos de doença de Graves e em 55% dos pacientes com tireoidite de Hashimoto. Raramente observam-se casos em que os anticorpos estão ausentes devido à produção de anticorpos restrita aos linfócitos intratireoidianos. Eles podem ser detectados, com menor freqüência, em outras patologias auto-imunes, em pacientes com carcinoma de tireóide e em percentuais ainda menores em mulheres e indivíduos idosos hígidos.
Geralmente, as amostras apresentam-se positivas para anti -TIREO e anti-TPO. A positividade isolada para os anticorpos antitireoglobulina é menos freqüente que o achado isolado dos anticorpos antitireoperoxidase.
Durante a gravidez, a presença de anticorpos anti-TPO e TRAB pode ser considerada fator preditivo de tireoidite pós-parto.
Durante as fases precoces da tireoidite de Hashimoto, encontramos anticorpos antitireoglobulina significativamente elevados e níveis menos elevados de anti-TPO. Tardiamente, os anticorpos anti-TIREO podem desaparecer, enquanto os anti-TPO permanecem presentes por muitos anos.
Pacientes que apresentam outras desordens auto-imunes, como síndrome de Sjögren, lúpus eritematoso sistêmico, artrite reumatóide e anemia perniciosa, podem apresentar anticorpos antitireoglobulina positivos.
Outro anticorpo utilizado na investigação clínica das patologias tireoidianas são os anticorpos anti-receptores de TSH (TRAB), que podem atuar tanto estimulando como inibindo as funções tireoidianas, ligando-se a diferentes epitopos. Encontram-se positivos na doença de Graves e nas tireoidites subagudas. Por sua capacidade de atravessar a barreira placentária, podem induzir à doença de Graves neonatal por transferência passiva.
A positividade do TRAB no soro sugere doença auto-imune em atividade, mas não define o estado funcional da glândula. O ensaio baseia-se na capacidade do soro que contém TRAB de impedir a ligação do TSH. Esse teste também é útil na avaliação de remissões ou recidivas da doença.
Por Tireóide às 13:11:00
Marcadores: Fisiologia
Paratireóides
Constituídas geralmente por quatro massas celulares, as paratireóides medem, em média, cerca de 6 mm de altura por 3 a 4 mm de largura e apresentam o aspecto de discos ovais achatados. Localizam-se junto à tireóide.
Seu hormônio - o paratormônio - é necessário para o metabolismo do cálcio.
Por Tireóide às 13:03:00
Marcadores: Anatomia, Paratireoide
Consumo de álcool durante a gravidez altera a função da tireóide
Para assegurar o desenvolvimento fetal normal, mãe e feto devem contribuir com níveis apropriados de hormônio da tireóide, em diferentes épocas da gestação. Caso contrário, pode resultar em defeitos no cérebro, alguns dos quais lembram aqueles encontrados em crianças sofrendo de síndrome alcoólica fetal (fetal alcohol syndrome - FAS). Devido a esses fatos em comum, alguns pesquisadores especulam que o álcool possa mediar defeitos de nascimentos relacionados ao álcool (alcohol-related birth defects - ARBDs) pela indução de condições de hipotireoidismo no útero.
Um estudo publicado na edição de janeiro da Alcoholism: Clinical & Experimental Research, investiga se o consumo de álcool durante o período equivalente ao terceiro trimestre em ovelhas resulta numa alteração da função da tireóide fetal ou maternal.
"O hormônio da tireóide exerce papéis importantes no crescimento, desenvolvimento e na função de outros hormônios e órgãos do sistema", explica Timothy A. Cudd, professor associado de psicologia na Texas A&M University e principal autor do estudo." No início do desenvolvimento, antes que o feto seja capaz de produzir o hormônio da tireóide, o hormônio materno atravessa a placenta para influir no desenvolvimento fetal. Num período posterior do desenvolvimento, quando maiores concentrações são requeridas para o desenvolvimento fetal normal, uma contribuição fetal é necessária para atingir as concentrações necessárias.
Cudd e co-autores sabiam que as anormalidades do cérebro encontradas em crianças que foram expostas a concentrações anormalmente baixas de hormônio da tireóide durante o desenvolvimento fetal são similares às anormalidades cerebrais encontradas em crianças expostas ao álcool "in utero". "De um ponto de vista comportamental, crianças nascidas de mães com hipotireoidismo mostram pior performance em inteligência, atenção, linguagem, leitura e desempenho escolar quando comparadas com crianças nascidas de mães com função normal da tireóide. Essas deficiências são similares àquelas em crianças com ARBDs. De uma perspectiva anatômica, tanto o hipotireoidismo quanto a exposição fetal ao álcool afetam o desenvolvimento do hipocampo e do cerebelo". Conhecendo essas similaridades, os autores do estudo investigaram se ARBDs são, em parte, um resultado da disfunção do sistema de hormônio da tireóide devido à mediação do álcool.
Os pesquisadores deram às ovelhas grávidas doses de álcool ou solução salina por três dias consecutivos, seguidos de quatro dias sem exposição, imitando um modelo de "bebedeira". Amostras de sangue fetal e materno foram coletadas nos dias 108 ou 132. "A administração de álcool às ovelhas durante o período equivalente ao terceiro trimestre de gravidez resultou em função alterada da tireóide em ambos, mãe e feto," disse Cudd.
Segundo Catherine Rivier, uma professora de neuroendocrinologia/neurociência do Salk Institute, "a ovelha é um bom modelo para o humano porque o sistema da tireóide de ambas as espécies se desenvolve de forma similar durante a gestação. Esses resultados mostram-nos que o álcool dado a uma mãe grávida abaixa os hormônios da tireóide em ambos, no feto e na mãe. Esta descoberta dá aos pesquisadores a razão para realizar experimentos adicionais para verificar se estas alterações nos hormônios da tireóide participam em defeitos devido a álcool durante a gestação".
Cudd acredita que as descobertas do estudo realmente sustentam a hipótese que o álcool possa intermediar ARBDs pela alteração da função da tireóide do feto e/ou da mãe. "Apesar disso, estudos adicionais são necessários para concluir que esse é o caso em humanos. Claramente, a abstenção do uso de álcool durante a gravidez é o caminho mais seguro. Entretanto, se nossas descobertas forem comprovadas para os humanos, então pode ser possível monitorar a função da tireóide e mesmo corrigir a função anormal da tireóide em mães para aliviar as ações do álcool no cérebro fetal".
Fonte: Alcoholism: Clinical & Experimental Research, 15/01/2002
Por Tireóide às 12:59:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Selênio pode reduzir doenças da tireóide após a gravidez.
O uso regular de selênio, um mineral que atua no sistema imunológico e na destruição dos radicais livres, pode reduzir em até três vezes as chances de as mulheres desenvolverem doenças da tireóide após a gravidez, segundo um estudo italiano recém-divulgado em congresso internacional de endocrinologia, nos EUA.
As mulheres com propensão genética a desenvolver doenças da tireóide têm mais chances de ter problemas após a gestação. O sistema imunológico passa a fabricar anticorpos que combatem a tireóide, como se fosse um órgão estranho.
A glândula se inflama e há uma queda na produção de hormônios. Em mais da metade dos casos, a tireoidite do pós-parto pode levar ao hipotireoidismo ou à tireoidite de Hashimoto, uma doença auto-imune.
No estudo do endocrinologista italiano Roberto Negro, os pesquisadores avaliaram 2.143 grávidas. Dessas, 169 manifestaram sinais (tinham anticorpos antitireoidianos) de que o organismo já tinha começado a fabricar anticorpos contra a tireóide. Metade desse grupo recebeu 200 microgramas de selênio por 12 meses (durante a gestação e no pós-parto) e a outra metade não.
Negro afirma que as mulheres que tomaram o selênio tiveram três vezes menos chances de desenvolver tireoidite após o parto. Mas ele é cauteloso quanto à indicação em larga escala do mineral. “Embora os resultados desse estudo sejam promissores, ainda não há justificativa para generalizar o uso do selênio nas mulheres grávidas”, afirma ele.
O mesmo cuidado tem o endocrinologista Mario Vaisman, professor da UFRJ (Universidade Federal do Rio de Janeiro). “O uso do selênio pode vir a ser uma indicação futura para aquelas grávidas que já têm sinais da tireoidite. Mas ainda precisamos de mais estudos”, afirmou o médico.
A endocrinologista do Hospital das Clínicas de São Paulo, Maria Fernanda Barca, se diz muito entusiasmada com o estudo italiano e já avalia a indicação para suas pacientes grávidas que apresentam sinais de tireoidite.
Um estudo desenvolvido pela endocrinologista no HC constatou que 13% das gestantes tinham doenças da tireóide.
“Há mais de dez anos não havia avanços nessa área, especialmente no que diz respeito à profilaxia. O uso do selênio poderá não só prevenir, mas também melhorar a evolução da doença”, acredita a médica. Segundo ela, o uso de selênio não traz riscos à gravidez.
Ela explica que, durante a gestação, as células imunológicas costumam ficar bloqueadas para que o organismo não rejeite o bebê. “Depois da gravidez, há um rebote da imunidade e, conseqüentemente, maior agressão à tireóide”.
Tanto Vaisman quanto Barca defendem que todas as grávidas façam exame para dosar os hormônios da tireóide durante a gestação. Hoje, o exame não faz parte do rastreamento de rotina das grávidas. No Japão, os médicos já dosam os hormônios durante a gravidez e no pós-parto.
“Às vezes, um estado nervoso depressivo passa por depressão pós-parto e, na verdade, a mulher está com uma disfunção tireoidiana”, explica Vaisman.
A dona-de- casa Daniela Muniz dos Santos, 32, descobriu a tireoidite quando estava no sexto mês de gestação do primeiro filho. “Eu engordei muito, sentia apatia, desânimo e o volume da tireóide estava visivelmente aumentado”, conta.
Com o diagnóstico de hipotireoidismo, ela passou a tomar hormônios para manter a função da tireóide, mas, na segunda gravidez, a glândula voltou a apresentar disfunção, mesmo com o medicamento.
A incidência das tireoidites é maior entre as mulheres e aumenta com a idade, sendo mais freqüente após a menopausa. Acima dos 35 anos, a proporção é de cinco a sete mulheres para cada homem com problemas.
Um estudo populacional das universidades estadual e federal do Rio de Janeiro, com 1.299 mulheres, revelou que 12,3% das que tinham mais de 35 anos sofriam de alguma forma de hipotireoidismo e 85% delas nem suspeitavam do problema.
O trabalho, coordenado pelo endocrinologista Mario Vaisman, revelou um dado preocupante: 34% das pesquisadas já tinham usado fórmulas emagrecedoras, que, entre outras substâncias perigosas, traziam hormônios tireoidianos. Todas essas mulheres já apresentavam supressão de hormônio TSH (que controla o funcionamento da tireóide).
Uma outra questão que divide a opinião dos médicos brasileiros é se o país enfrenta ou não um aumento das doenças da tireóide. Em São Paulo, desde março, uma comissão formada pelo Centro de Vigilância Epidemiológica do Estado, empresas e universidades checam o aumento de casos de tireoidite entre os moradores do pólo petroquímico do ABC paulista.
O alerta foi dado por uma médica da região e confirmado por análises do Instituto Adolfo Lutz. Os testes feitos pelo laboratório público indicaram 78% mais casos no pólo do que em Diadema, uma cidade com características industriais idênticas, mas sem a presença de petroquímicas. Ainda não há dados conclusivos.
Já o endocrinologista Geraldo Medeiros Neto, professor da Faculdade de Medicina da USP, refuta a tese ambiental e defende que o aumento dos casos de tireoidite se devem ao fato de que, durante cinco anos (de 1998 a 2003), a quantidade de iodo adicionado ao sal foi excessiva (40 a 100 miligramas de iodo por quilo de sal).
Segundo ele, a ingestão exagerada de iodo desperta no organismo uma reação chamada de auto-imunidade: o sistema imunológico (que produz anticorpos) volta-se contra a tireóide, resultando em doença chamada de tireoidite crônica ou tireoidite de Hashimoto.
Outros médicos avaliam que o aumento se deve unicamente ao fato de que hoje há mais investigação dos casos de tireoidite e, por isso, mais casos são diagnosticados.
Fonte: jornalpequeno.com.br
Por Tireóide às 12:54:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Tireóide: auto-exame
Os sintomas descritos anteriormente podem ser acompanhados ou não de alterações na forma da tireóide, como aumento de volume ou a presença de nódulos. Estes achados podem ser pesquisados em um auto-exame. Veja como fazê-lo:
O material necessário: Copo com água e um espelho (se possível, de cabo).
1. Segure o espelho e procure no seu pescoço a região logo abaixo do Pomo de Adão (popularmente conhecido como gogó). Sua tireóide está localizada aí.
2. Estenda a cabeça para trás para que esta região fique mais exposta. Focalize-a pelo espelho.
3. Beba um gole de água e engula.
4. Com o ato de engolir, a tiróide sobe e desce. Observe se há alguma protrusão ou nódulos na sua tiróide. Atenção: Não confunda a tireóide com seu Pomo de Adão. Repita este teste várias vezes até ter certeza.
5. Ao notar protrusões, procure seu Endocrinologista.
Glândula Tireóide e Glicemia.
A glândula tireóide é responsável por produzir hormônios que regularizam nosso metabolismo energético. Existem estudos que comprovam que o número de pessoas com diabetes tipo 1 que também desenvolvem doenças de tireóide é muito grande. Portanto, é recomendada a avaliação da função tiroidiana nos pacientes portadores de diabetes tipo 1 já no diagnóstico inicial da doença.
Os portadores de diabetes tipo 1 no período inicial do diagnóstico podem apresentar algumas "substâncias" no sangue (marcadores auto imunes) contra a célula. De 85 a 90% das pessoas com diabetes têm estas substâncias no início da doença. Muitos destes pacientes podem apresentar outros anticorpos não relacionados ao diabetes.
A doença da tireóide pode ser apresentada de duas maneiras: o excesso de função, hipertireoidismo, e a diminuição da função, o hipotireoidismo. O hipertireoidismo é caracterizado pela elevação dos hormônios tireoidianos no sangue, o T3 e o T4, e a diminuição do hormônio produzido pela hipófise que estimula a tireóide a funcionar, o TSH. Como conseqüência, o paciente pode ter os seguintes sintomas: insônia, batedeira, queda de cabelo, pele úmida, sudorese, unha fraca, muita fome e perda de peso.
O aumento destes hormônios provoca a elevação na produção de glicose no organismo, que é jogada para a circulação. Em uma pessoa que não tem diabetes essa alteração é compensada pela produção de insulina, mas em quem tem diabetes isso pode significar piora do controle glicêmico.
No hipotireoidismo, ao contrário, os hormônios da tireóide estão diminuídos ou no limite mínimo da normalidade e o hormônio da hipófise, o TSH, encontra-se elevado. O paciente apresenta sonolência, cansaço, pele seca, eventual queda de cabelo e pode ocorrer aumento do peso. O controle da glicemia também pode ficar difícil, com maior incidência de episódios de hipoglicemia. O hipotireoidismo provoca um acúmulo de gorduras no sangue (lípides), o que pode aumentar o risco de complicações do diabetes.
Por isso é tão importante investigarmos a possibilidade da associação da doença tireoidiana quando temos diabetes e, principalmente, quando estamos tendo dificuldade em ajustar a dose de insulina ou de manter nosso controle adequado. O simples exame de TSH pode ser suficiente para detectarmos a presença de uma doença tireoidiana associada ao diabetes. Mesmo para aqueles que já têm hipotiroidismo ou hipertiroidismo é possível desta forma verificar se há necessidade de ajuste na dose da medicação do controle da tireóide e com isso auxiliar no controle da glicemia.
fonte: bengalalegal.com.br
Por Tireóide às 12:36:00
Marcadores: Doença Relacionada à Tireóide
Alimentação, Tireóide e Enxaqueca
Qual a importância da glândula tireóide na enxaqueca?
Acontece que distúrbios da tireóide são um grande motivo de desencadeamento ou agravamento de enxaqueca.
Além disso, podem provocar outras dores de cabeça!
Segundo as estatísticas, os problemas da tireóide têm se tornado cada vez mais comuns, e geralmente demoram para ser diagnosticados.
Vocês poderiam se perguntar qual a razão desse aumento dos distúrbios da tireóide.
A resposta pode ser encontrada, em boa parte, na alimentação.
Como veremos nesta, vários itens comuns do cardápio cotidiano, para nossa surpresa, não são tão benéficos quanto parecem.
Com tantas informações surpreendentes que a ciência possui sobre os malefícios de ingredientes tão comuns e rotineiros, é natural nos perguntarmos:
- O que comer, então?
Este é o tema da Parte 2 desta matéria.
Como você verá na Segunda Parte, a melhor resposta a essa pergunta pode ser encontrada na culinária tradicional. Aquela das avós de nossas bisavós, que sua vez, aprenderam de seus antepassados, e graças aos quais existimos hoje.
Infelizmente, interesses econômicos têm provocado desvios na visão de muitos cientistas, que se acham deuses capazes de melhorar os alimentos que existem na natureza. Felizmente, existe também uma ciência séria, que demonstra o prejuízo do processamento industrial dos alimentos em nome de uma pretensa comodidade. Porém, precisamos nos lembrar, todos os dias, de que não é nada cômodo ficar doente!
Se você deseja evitar ou minimizar problemas de tireóide, EVITE:
1. Soja
Se você está apresentando problemas de tireóide, uma das primeiras medidas úteis é cortar totalmente o uso de soja.
Por sinal, ela é utilizada em mais de 60% dos alimentos industrializados (vide rótulos, inclusive de salsicha e peito de peru e carne processada para hambúrgueres), seja na forma de proteína, óleo, lecitina, etc.
A soja possui grandes quantidades dos seguintes antinutrientes:
a) Ácido fítico, que se liga a importantíssimos minerais da alimentação, especialmente o zinco, cálcio e magnésio, impedindo sua absorção;
b) Inibidores da tripsina (a tripsina é uma enzima importante do nosso organismo, utilizada no processo de digestão);
c) Isoflavonas, genisteína e daidzeína, substâncias que possuem atividade antitireoideana demonstrada cientificamente.
Pesquisas mostram que as isoflavonas da soja, que se encontram "na moda" para inúmeras "utilidades", como se fossem panacéias, são, na verdade, os mais potentes inibidores da função tireoideana, seguidas pela daidzeína e, em terceiro lugar, a genisteína. Nenhum outro alimento, na nossa realidade, possui mais antinutrientes que a soja!
2. Açúcar e Farináceos
O delicado mecanismo de controle dos níveis de açúcar no sangue (glicemia) requer uma ação muito bem coordenada entre a insulina do pâncreas, e outros hormônios de diversas glândulas, entre as quais as supra-renais e a tireóide.Quando o açúcar e o amido são ingeridos na sua forma natural, não-refinada, como parte de uma refeição contendo gorduras e proteínas saudáveis e nutritivas, a sua digestão ocorre lentamente, permitindo que o açúcar entre na corrente sangüínea num ritmo gradual e moderado, ao longo de várias horas.Se o organismo permanecer sem comida durante muito tempo, o nosso mecanismo de controle aciona as reservas de açúcar armazenadas no fígado.Assim, esse fantástico processo de regulação do açúcar no sangue garante às células um suprimento uniforme e constante da substância. Em conseqüência, o organismo como um todo se mantém estável, física e emocionalmente.Por outro lado, quando consumimos açúcar e farináceos refinados, praticamente sem nada mais, ou seja, desacompanhados de gorduras e proteínas em proporções significativas, a digestão se dá muito rapidamente, provocando um aumento súbito do açúcar na corrente sangüínea. Em resposta, ocorre uma produção de quantidades imensas de insulina, hormônios da tireóide e vários outros, na tentativa de baixar o açucar do sangue para níveis aceitáveis.Conforme o organismo vai sendo tomado de assalto, repetidamente, por concentrações excessivas de açúcar, é possível uma quebra no seu delicado mecanismo de controle dessa substância. Nessa situação, vários componentes desse mecanismo podem permanecer em constante estado de hiperatividade, resultando no desgaste e insuficiência de alguns deles, entre os quais a glândula tireóide.
Tal situação é exacerbada pelo fato de uma dieta rica em açúcar e farináceos refinados ser pobre em vitaminas, minerais e enzimas, elementos necessários para a manutenção adequada das glândulas e seus hormônios, que uma vez desequilibrados, provocam a manifestação de dores de cabeça, crises de enxaqueca, alergias, obesidade, depressão, distúrbios comportamentais e de aprendizado.
3. Óleos Vegetais Comuns
A campanha contra as gorduras saturadas e a favor dos óleos vegetais poliinsaturados (canola, milho, soja, margarina, etc) na culinária é boa apenas para a indústria alimentícia, e não para a sua saúde. Quase todos os alimentos industrializados, incluindo pães, bolachas, biscoitos, salgadinhos, batatinhas, molhos, doces, produtos com zero de colesterol, maioneses, sorvetes e cereais matinais, contêm gorduras vegetais poliinsaturadas e/ou hidrogenadas. Fazem parte, freqüentemente, de cardápios vegetarianos. Até mesmo a assim chamada gordura saturada do frango, porco e carnes de bois criados em confinamento, encontra-se alterada devido à alimentação desses animais à base de soja, milho e outros produtos ricos em poliinsaturados.
Acontece que, entre outros problemas, as gorduras poliinsaturadas inibem a liberação do hormônio da tireóide. Como? Através da inibição de enzimas proteolíticas. Essas enzimas são importantes na digestão de proteínas. Sem elas, a digestão da proteína coloidal que é liberada pela tireóide e guarda dentro de si os seus hormônios, é prejudicada. Sem a digestão do colóide, não há liberação dos hormônios.
O hormônio da tireóide é essencial na fabricação, a partir do colesterol, de uma série de hormônios esteróides, como a progesterona, pregnenolona e o assim chamado DHEA, conhecido como hormônio anti-envelhecimento. Na insuficiência tireoideana, o colesterol, matéria-prima de todos os hormônios esteróides, pode se acumular e se elevar. E com a diminuição da progesterona, aumentam as chances de ocorrer uma dominância estrogênica, que contribui para a atual epidemia de TPM, cólicas menstruais, cistos ovarianos, nódulos mamários e câncer.
4. Certas Verduras Cruas
Algumas verduras cruas contêm substâncias naturais chamadas glucosinolatos, as quais podem interferir negativamente com a produção de hormônios da tireóide. Entre essas verduras estão o repolho, brócolis, couve-de-bruxelas, couve-flor e espinafre. Existe uma maneira de tornar saudável o consumo dessas importantes verduras.
Para prevenir ou minimizar problemas de tireóide:
1. Crie o hábito de comer peixe, principalmente de águas frias e profundas do oceano. Além de serem ricos em ácidos graxos ômega-3, são excelentes fontes de iodo, fundamental para o funcionamento da glândula tireóide, além de minerais como o selênio e o magnésio.
2. Minimize o consumo de açúcar e farináceos. Como explicamos no último boletim, altos níveis de açúcar no sangue podem desregular o funcionamento da sua glândula tireóide.
3. Consuma alimentos ricos em iodo. O iodo é necessário, em pequenas quantidades, para a função da glândula tireóide, assim como o metabolismo das gorduras, produção de hormônios sexuais e uma série de processos bioquímicos. Cãibras musculares, dores de cabeça, depressão, pés frios, mãos geladas e ganho de peso podem ser sinal de deficiência dessa substância. Deficiências de iodo podem aumentar a sucetibilidade para doenças como o câncer de mama e a pólio. Alguns alimentos ricos em iodo são: frutos do mar, sal não refinado, algas marinhas, caldo de peixe caseiro, manteiga (não margarina), abacaxi, alcachofra, aspargos e uma série de verduras de coloração mais escura. Para que possa ser utilizado pelo organismo, o iodo requer níveis adequados de vitamina A, que são obtidos através da ingestão de manteiga e gorduras de origem animal em moderação (de animais criados soltos, e não em cativeiro ou à base de ração). O iodo em excesso pode ser tóxico para nosso organismo, por isso não se recomenda o consumo excessivo de algas ou de sal iodado.
4. Algumas palavras de precaução quanto ao consumo de algas: embora as algas marinhas sejam ricas em iodo e uma série de outros minerais, seu consumo excessivo pode causar intoxicação pelo próprio iodo. Algumas pessoas não possuem a enzima capaz de digerir o carboidrato complexo presente nas algas. Muitas algas comerciais são tratadas com pesticidas e fungicida durante o processo de secagem e armazenamento, por esse motivo é importante que você conheça os métodos utilizados pelo seu fornecedor. Por fim, recomenda-se deixar as algas de molho por um período de 6 horas, a fim de auxiliar sua digestão.
5. Prepare caldo de peixe em casa, à moda dos nossos ancestrais, utilizando carcaças e cabeças, ricas em minerais, inclusive o iodo. Além disso, as cabeças dos peixes são fontes diretas de hormônios da tireóide, além de outras substâncias que nutrem essa glândula. Quatro mil anos atrás, os médicos chineses rejuveneciam seus pacientes idosos através de uma sopa feita com as tireóides de animais. Segundo os textos antigos, esse tratamento ajudava os pacientes a se sentirem remoçados, com mais energia e capacidade mental. Na Inglaterra do período vitoriano, os médicos prescreviam sanduíches especiais de tireóide crua para seus pacientes mais doentes. Embora tal sanduíche não ofereça o menor apelo ou atração para nosso paladar, as sopas, molhos e caldos feitos a partir do caldo de peixe caseiro são uma verdadeira delícia! Um “remédio” impossível de recusar!! Algumas pesquisas indicam que até 40% das pessoas podem estar sofrendo de alguma deficiência da glândula tireóide e seus respectivos sintomas de fadiga crônica, ganho de peso, dificuldade em perder peso, resfriados e gripes freqüentes, unhas quebradiças, cabelos fracos, dificuldade de concentração, dores de cabeça, depressão e uma série de complicações mais sérias, como doenças cardiovasculares e câncer. Por que não incluirmos um caldo de peixe caseiro em nossa dieta, tanto quanto possível?
6. Inclua ovas de peixe na sua alimentação. As ovas sempre foram valorizadas pelos povos primitivos do planeta, pela sua capacidade de auxiliar a prevenir problemas da tireóide, promover a fertilidade e nutrir mulheres grávidas e crianças em fase de crescimento.
7. Como vimos no último boletim, algumas verduras cruas contêm substâncias naturais chamadas glucosinolatos, as quais podem interferir negativamente com a produção de hormônios da tireóide. Entre essas verduras estão o repolho, brócolis, couve-de-bruxelas, couve-flor e espinafre. Evite o seu consumo diário na forma crua. Para neutralizar esse efeito potencialmente prejudicial à tireóide, basta cozinhar essas verduras, ligeiramente, no vapor, em água ou em sopas. Ocasionalmente, pode-se – e até deve-se – consumir essas verduras cruas, pois somente quando cruas elas possuem importantes propriedades anti-câncer (por conta daqueles mesmos glucosinatos que são neutralizados pelo cozimento). A sabedoria está em não consumi-las cruas diariamente, mas sim ocasionalmente.
8. Consuma grãos, cereais e sementes integrais que tenham sido deixados de molho por 7 a 24 horas, em água com gotas de limão ou 1 colher (sopa) de soro de iogurte ou seu soro. Faça isso com o feijão, arroz integral, grão-de-bico, lentilhas, trigo, aveia e todos os grãos e cereais que você consumir. Esse procedimento neutraliza substâncias potencialmente prejudiciais à tireóide, denominadas antinutrientes. O único grão que não obedece essa regra é a soja, pois seus antinutrientes não são neutralizados por tais procedimentos. Por essa razão, seu consumo deve ser evitado ao máximo!
fonte: enxaqueca.com.br
Por Tireóide às 12:19:00
Marcadores: Doença Relacionada à Tireóide
Cirurgia de Tireóide
A cirurgia a tiróide compreende procedimentos de ressecção que variam desde a retirada de um nódulo separadamente, até a ressecção completa da glândula.
O tipo de cirurgia a ser realizado para cada tipo de patologia deve ser cuidadosamente estudado, e sofre algumas variações de conduta, para certas patologias, de acordo com a conduta de cada serviço ou cirurgião.
Como toda cirurgia, em qualquer segmento do corpo humano, existe risco potencial de complicações. A cirurgia da tiróide comporta, em especial, chance potencial de lesão dos nervos laríngeo recorrente, laríngeo superior e glândulas paratireóides. Estudos dos grandes serviços de cirurgia demonstram variação no índice de complicações, entre 0,4 a 5% das tireoidectomias realizadas.
Lobectomia Unilateral
Ressecção do lobo esquerdo da tiróide e istmo. Utilizada para tratamento de nódulo unilateral benigno. Alguns serviços utilizam esta técnica como cirurgia curativa do carcinoma papilífero da tiróide.
Tiroidectomia Parcila Bilateral
Ressecção parcial de ambos lobos tireoidianos e total do istmo, restando cerca de 6 gramas de tecido glandular. Cirurgia padrão para tratamento Hipertiroidismo - Bócio Multinodular Tóxico,
Tiroidectomia Total
Ressecção de toda tireóide, utilizada para tratamento de tumores malignos tiroidianos.
Por Tireóide às 21:17:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Por Tireóide às 21:14:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Por Tireóide às 21:13:00
Marcadores: Doença Relacionada à Tireóide, Doenças

Glândula tiroidiana apresentando múltiplas áreas com captação menor do que o restante do parênquima- nódulos hipocaptantes ou frios. Compatível com BÓCIO MULTINODULAR
Por Tireóide às 21:12:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Nódulos de Tireoide e Exames para Diagnóstico
Os nódulos tireoidianos estão presentes em cerca de 10% da população em geral. São mais freqüentes em mulheres do que nos homens, na proporção aproximadamente de 5:1.
A MAIORIA DOS NÓDULOS DA TIRÓIDE SÃO BENIGNOS, apenas cerca de 5% são malignos (câncer)
Os nódulos tireoidianos podem ser únicos ou múltiplos, localizando-se em apenas um lobo ou em toda extensão da tireóide.
QUANTO MAIOR O NÚMERO DE NÓDULOS, MENOR A POSSIBILIDADE DE SER CÂNCER, os pacientes que mais tem chance de ter nódulo maligno, são os portadores de nódulo solitário, e se encontram nos extremos da idade (jovens e idosos). Mesmo assim apenas cerca de 10 a 20% destes são malignos.
Diversas patologias tireoidianas se apresentam como nódulos benignos, dentre as mais freqüentes são os adenomas, tiroidite de Hashimoto, cistos tiroidianos, tiroidite de Riedel, etc..
No processo de investigação dos nódulos tiroidianos, após a amamnese (história do paciente) e o exame físico, costuma-se formar uma hipótese diagnóstica, e através dos exames complementares se completa o diagnóstico.
Exame de Sangue
Com a dosagem sanguínea do TSH, T3, T4 ou T4L pode-se definir se a glândula funciona de modo normal, se produz mais hormônio do que deveria (hipertiroidismo), ou menos do que o normal (hipotiroidismo), e se a origem da patologia é na própria tireóide ou na hipófise.
A dosagem dos anticorpos anti-tireoglobulina, anti-microssomial ou anti-TPO permite verificar a presença de patologia autoimune como a Tiroidite de Hashimoto.
Cintilografia ou Scan
A cintilografia da tiróide é feita com a ingestão de iodo ou tecnésio radiotivos, de curta meia vida, que serão absorvidos e concentrados na tiróide. Através do cintilógrafo, radiação emitida é captada e transformada em imagem, que posteriormente é interpretada. O resultado indica o estado funcional da glândula, que pode ser: normal, aumentada nos casos de hipertiroidismo ou mesmo diminuída quando há hipotiroidismo.
A captação dos nódulos em relação ao parênquima do restante da glândula também é avaliada. Quando o nódulo concentra mais radioiodo do que o restante da glândula é chamado de hipercaptante ou quente, naqueles em que a captação é semelhante denomina-se normocaptante ou morno, e os que captam menos são os hipocatantes ou frios. Estes últimos são os que mais preocupam pois podem ser, em 5 % dos casos, nódulos malignos.
Este exame tem como inconveniente o fato de não poder distinguir os diversos tipos de nódulos frios. Tanto os nódulos císticos como os mistos ou os sólidos revelam o mesmo tipo de imagem. Destes, o que detém maior possibilidade de malignidade é o nódulo sólido
O Scan de corpo inteiro é utilizado como acompanhamento pós operatório dos pacientes submetidos a tratamento do câncer da tireóide, na procura por metástases.
Ultra-Som
O ultra-som da tireóide é o exame de eleição para se determinar as características morfológicas da glândula e dos nódulos, se são sólidos, mistos ou císticos. Único ou múltiplos, se todos semelhantes ou algum que destoa do grupo. Pode-se verificar se o parênquima tiroidiano é homogêneo ou heterogêneo.
Biópsia com Agulha Fina
O que mais preocupa o médico e em especial o paciente é a possibilidade do nódulo em investigação ser maligno (câncer). Para tal uma seqüência de exames é realizada, destacando-se PUNÇÃO ASPIRATIVA COM AGULHA FINA - PAAF, também conhecida como punção biópsia de tireóide com agulha fina. Este método permite a retirada de células do nódulo tiroidiano e diagnóstico através do exame citopatológico. É inócuo, pouco doloroso, mesmo quando realizado sem anestesia e permite que um acerto diagnóstico em cerca de 90% dos casos, quando realizado por equipe experiente.imagens
Com o paciente deitado em decúbito dorsal (deitado de costas), com travesseiro sob os ombros palpa-se o nódulo tireoidiano, fixando-o entre os dedos e com a outra mão realiza-se a punção e aspiração do mesmo. O material e transferido para lâminas de vidro, feito o esfregaço e imerso imediatamente em álcool 95%, para ser encaminhado ao citologista.
Para maior precisão e melhores resultados realizamos também a PAAF sob visão direta da ultrassonografia, que nos permite localizar com maior facilidade o nódulo dominante e puncioná-lo com 100% de acerto. Também facilita achar em meio a diversos nódulos aqueles com maiores possibilidade de ser de natureza maligna, aspirar a parte sólida de um nódulo misto, e etc. Quando associado ao doppler colorido, pode-se desviar a agulha de vasos sanguíneos mais calibrosos do interior do nódulo e também verificar o tipo de vascularização que nutre a tumoração, quando predominantemente periférica, maior a probabilidade é que o mesmo seja benigno, e quando os vasos se concentram no seu interior,são maiores as chances de se tratar de câncer.
Tomografia Computadorizada
A tomografia computadorizada do pescoço não é exame realizado regularmente, em geral está indicado nos casos de volumosos bócios, em especial nos bócios mergulhantes e em tumores malignos agressivos que podem estar invadindo estruturas adjacentes à tireóide.
Por Tireóide às 21:02:00
Marcadores: Doença Relacionada à Tireóide, Doenças, Exames, Nódulo
Tireoidite Linfocítica Silenciosa
A tireoidite linfocítica silenciosa ocorre mais freqüentemente em mulheres, tipicamente logo após o parto, e faz com que a tireóide aumente de tamanho sem provocar dor. Em um período que varia de várias semanas a vários meses, o indivíduo afetado apresenta hipertireoidismo seguido por hipotireoidismo, antes da função da tireóide finalmente normalizar. Essa condição não requer tratamento específico, embora o hipertireoidismo e o hipotireoidismo possam exigir tratamento por algumas semanas. Freqüentemente, um betabloqueador (p.ex., propranolol) é o único medicamento necessário para controlar os sintomas do hipertireoidismo. Durante o período de hipotireoidismo, pode ser necessária a administração de hormônio tireoidiano, normalmente por apenas alguns meses. O hipotireoidismo torna-se permanente em aproximadamente 10% dos indivíduos com tireoidite linfocítica silenciosa.
Por Tireóide às 20:44:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Tireoidite Granulomatosa Subaguda
A tireoidite granulomatosa subaguda (de células gigantes), a qual é provavelmente causada por um vírus, inicia muito mais abruptamente que a tireoidite de Hashimoto. Freqüentemente, a tireoidite granulomatosa subaguda ocorre após uma doença viral e começa com o que muitas pessoas chamam de inflamação da garganta, mas que, na realidade, é uma dor no pescoço, localizada na tireóide. A tireóide torna-se cada vez mais dolorosa e, normalmente, o indivíduo apresenta uma febre baixa (37,2 a 38,3 oC). A dor pode deslocar- se de um lado a outro do pescoço, irradiar para a mandíbula e para os ouvidos e pode aumentar de intensidade quando a cabeça é rodada ou com a deglutição. No início, a tireoidite granulomatosa subaguda é freqüentemente confundida com um problema dentário ou com uma uma infecção da garganta ou do ouvido.
Comumente, a inflamação faz com que a tireóide libere uma quantidade excessiva de hormônio tireoidiano, acarretando hipertireoidismo, o qual é quase sempre seguido por um hipotireoidismo temporário. Muitos indivíduos com tireoidite granulomatosa subaguda apresentam uma fadiga extrema. A maioria dos indivíduos recupera-se completamente desse tipo de tireoidite. Geralmente, o problema desaparece espontaneamente em alguns meses. Algumas vezes, no entanto, ele recorre ou, mais raramente, ele produz uma lesão da tireóide suficiente para causar um hipotireoidismo permanente. A aspirina ou outros antiinflamatórios não esteróides (p.ex., ibuprofeno) podem aliviar a dor e inflamação. Nos casos muito graves, o médico pode prescrever corticosteróides (p.ex., prednisona), cuja dose deve ser reduzida progressivamente ao longo de 6 a 8 semanas. Quando o uso de corticosteróides é interrompido abruptamente, os sintomas freqüentemente retornam com força total.
Por Tireóide às 20:44:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Síndrome do Doente Eutireoideu
Na síndrome do doente eutireoideu, os resultados dos exames da tireóide são anormais, embora a glândula apresente uma função normal. A síndrome do doente eutireoideu geralmente ocorre em indivíduos que apresentam uma doença grave que não seja a doença da tireóide. Nos indivíduos doentes, desnutridos ou que foram submetidos a uma cirurgia, a forma de T4 do hormônio tireoidiano não é normalmente convertida na forma de T3. Ocorre um acúmulo de grandes quantidades de T3 reversa, uma forma inativa do hormônio tireoidiano. Apesar dessa conversão anormal, a tireóide continua a funcionar e a controlar normalmente a taxa metabólica do organismo. Como a tireóide não apresenta problema, nenhum tratamento é necessário. Uma vez curada a doença subjacente, os exames laboratoriais revelam resultados normais.
Por Tireóide às 20:43:00
Marcadores: Doença Relacionada à Tireóide, Doenças
TIREÓIDE E PSIQUIATRIA
EIXO HIPOTÁLAMO-HIPÓFISE-TIREOIDEANO E PSIQUIATRIA
Em pessoas normais a secreção de TSH aumenta durante a noite, quando os níveis de T3 e T4 diminuem. Em pacientes deprimidos esse ritmo circadiano da TSH pode estar perturbado, chegando a haver ausência do pico noturno de secreção de TSH (Duval,1990). Estas alterações tendem a normalizar-se com a cura do Episódio Depressivo (Souetre,1988).
É antigo o interesse da psiquiatria em relação aos níveis de hormônios tireoideanos e a depressão. Joffe (2000) pesquisou a relação entre o curso vital da doença depressiva e os níveis basais dos hormônios triiodotirodina (T3), tiroxina (T4) e tireotrofina (TSH) em 75 pacientes com Transtorno Depressivo Unipolar e concluiu que o tempo de recorrência da depressão grave (ou Maior pelo DSM.IV) se relaciona de forma inversa aos níveis de T3, mas não com os níveis do T4.
Muitas pesquisas foram realizadas com o teste de estimulação com TSH em pacientes psiquiátricos. O fato de ter-se constatado que 25 a 30% das pessoas deprimidas, e sem alteração prévia de tireóide, apresentavam uma diminuição na resposta de TSH mediante a administração de TRH, animou muitos pesquisadores quanto à uma pretensa maneira laboratorial de se detectar a depressão (Loosen, 1982; Baumgartner, 1995; Holsboer, 1995).
Entretanto, esta anomalia não se mostrou específica da Depressão Maior (ou Grave, pelo CID.10). Ela aparece também nos pacientes maníacos, esquizofrênicos, esquizoafetivos, em alcoolistas e nos pacientes que sofrem ataques de pânico.
Outros estudos procuraram definir, então, o perfil clínico dos pacientes cujas respostas do teste de estimulação pelo TSH estavam diminuídos. O que se pode constatar é que estes pacientes, se têm algo em comum, era uma maior freqüência de agitação, de características psicóticas, de risco de suicídio, de ataques de pânico ou de depressão crônica (Joffe & Levitt, 1993).
Apesar do teste de estimulação para o TSH alterado não acontecer nos Transtornos de Personalidade com sintomatologia afetiva, ele não é específico para depressões como gostariam muitos pesquisadores. Além disso, há inúmeras possibilidades de resultados falsos positivos e falsos negativos, o que acaba por tornar problemática sua utilização na prática clínica.
Como, exatamente, se desenvolve um quadro depressivo no Hipotireoidismo ainda não está bem esclarecido. Em ratos, o Hipotireoidismo associado à extirpação cirúrgica da tireóide (tireoidectomia) afeta o sistema noradrenérgico, sendo aventada possível ligação entre esta ocorrência e alteração em funções neuropsíquicas.
Outra possibilidade é a de que o hipotireoidismo se associa com uma redução na atividade da serotonina. Com a reposição de medicamentosa de Tiroxina a 7 pacientes hipotireóideos, Cleare e cols. observaram melhora dos sintomas depressivos e melhora da atividade serotonérgica, em todos eles. Esses achados sugerem que a neurotransmissão serotonérgica é afetada pelo hipotireoidismo e revertida com reposição de T4.
Miriam Oliveira destaca achados de alto número de pacientes hipotireóideos com sintomas sugestivos de transtornos depressivos, sugerindo que muitos desses pacientes poderiam ser beneficiados com avaliação e atendimento psiquiátrico adequados concomitante ao tratamento endócrino (Miriam C. Oliveira et al, 2001).
O quadro psicológico classicamente associado ao hipotireoidismo é um quadro de ansiedade severa e agitação, manifestado por alucinações, comportamento paranóide e até demência, quadro este conhecido por "loucura mixedematosa". Esse tipo de demência associada ao hipotireoidismo é, felizmente, reversível com a reposição hormonal (Clarnette, 1994).
A par do que se sabe, concretamente, das alterações da tireóide na depressão (e vice-versa), também nos casos de Estresse o funcionamento da glândula está alterado. Há uma diminuição da produção de TSH pela hipófise e uma inibição da conversão de T4 em T3. Trata-se de um mecanismo fisiológico de defesa e proteção no Estresse, provocado pelos corticóides, com objetivo de conservar a energia durante a reação de alarme (veja mais sobre a Fisiologia do Estresse).
Pacientes com Anorexia Nervosa apresentam também uma alteração característica que pode, à primeira vista, parecer contraditória. Alguns sintomas da Anorexia são sugestivos tanto de hipotireoidismo (bradicardia, diminuição do reflexo aquileo, aumento do colesterol), como de hipertireoidismo (hiperatividade, aumento do metabolismo basal).
Por Tireóide às 20:39:00
Marcadores: Doença Relacionada à Tireóide, Doenças
TIREÓIDE E EMOÇÕES
Alterações de tireóide junto com alterações psiquiátricas são muito comuns, chegando a chamar atenção dos clínicos, psiquiatras e endocrinologistas. Explicar, entretanto, se elas ocorrem porque a tireóide interfere no psiquismo ou se o psiquismo interfere na tireóide tem sido objeto de muitos estudos.
Evidentemente as patologias primárias da tireóide, como as tireoidites, por exemplo, acabam por produzir uma rica sintomatologia emocional. Mas, o assunto fica mais delicado quando, por exemplo, constatamos em pacientes psiquiátricos alterações funcionais na tireóide.
O que é na prática inquestionável, é o fato dos tratamentos psiquiátricos melhorarem muito a função da tireóide alterada e vice-versa. Além disso, em depressões resistentes e quando precisamos de um tratamento mais rápido, a associação dos antidepressivos com hormônios tereoideanos é brilhante.
As anomalias funcionais da glândula tireóide (ou tiróide) são freqüentes, acometendo cerca de 5 % da população geral, com forte predomínio nas mulheres. Calcula-se que, no mundo, mais de 200 milhões de pessoas sofrem com alguma forma de doença da tireóide.
A glândula tireóide pode produzir hormônio demais (hipertireoidismo), ou de menos (hipotireoidismo), fazendo o corpo usar energia mais lentamente do que ele deve.
Trata-se, a Tireóide, de uma glândula localizada na região anterior do pescoço que possui importante papel no controle do metabolismo do organismo.
Ela produz os hormônios tireoideanos (T4 e T3), que modulam a velocidade com que a energia será consumida. A glândula tireóide é estimulada a produzir o T3 e T4 por outro hormônio, o TSH (hormônio tíreo-estimulante ou tireotrofina), produzido na Hipófise (glândula situada no cérebro).
A Hipófise, por sua vez, é estimulada a produzir o TSH por outro hormônio ainda, o TRH (hormônio liberador da tireotrofina), este produzido no Hipotálamo (uma área do cérebro).
Por Tireóide às 20:38:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Sintomas psiquiátricos do Hipertiroidismo
HIPERTIREOIDISMO
Sintomas Psiquiátricos
Neste caso há também um quadro depressivo, entretanto, aqui a depressão costuma ser do tipo agitado, com alto grau de ansiedade. Com freqüência os pacientes se queixam de fadiga associada a insônia.
Alguns transtornos psicóticos, de aspeto confusional e delirante, sobretudo se manifestam em casos de fortes crises agudas ou de fases muito avançadas de hipertireoidismo. Nos idosos a apatia é freqüente, havendo instabilidade do humor, do tipo disfórico, ansiedade e, menos freqüentemente, um quadro de melancolia.
Esses sintomas neuropsiquiátricos do hipertireoidismo podem desaparecer apenas com um tratamento antitireoideano (por exemplo, com carbimazol, propiltiuracil, etc). Quando existem manifestações psicóticas é necessária a prescrição de antipsicóticos e neurolépticos, mesmo durante o tratamento endocrinológico.
Por Tireóide às 20:35:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Sintomas psiquiátricos do Hipotireoidismo
HIPOTIREOIDISMO
Sintomas Psiquiátricos
Quando o hipotireoidismo é de intensidade média, a sintomatologia é, predominantemente, dominada por um quadro depressivo, ao qual se associam lentificação da fala, diminuição do rendimento intelectual, fadiga, diminuição do apetite e apatia.
A forma mais grave de alteração emocional decorrente do hipotireoidismo é chamada de loucura mixedematosa (mixedema é um quadro de edema geral de origem tireoideano), que se caracteriza por um quadro verdadeiramente psicótico, do tipo confusional, delirante e alucinatório ou, quando não, por um profundo estado melancólico, com freqüência estuporoso. Algumas outras raras vezes a alteração do humor se dá por uma quadro de hipomania. Nos idosos essas alterações podem lembrar um quadro demencial.
Por Tireóide às 20:33:00
Marcadores: Doença Relacionada à Tireóide, Doenças
Ações dos hormônios da tireóide
As principais funções desses hormônios são:
• aumento da força de contração do coração e da freqüência cardíaca
• aumento do consumo de oxigênio, portanto, aumento da taxa metabólica
• redução dos níveis de colesterol por aumento de sua excreção
• aumento da absorção de glicose pelos tecidos, potencializando da ação da insulina
• aumento do metabolismo proteico nos músculos e nos ossos
• estímulo da queima de gorduras (lipólise)
Por Tireóide às 20:27:00
Marcadores: Fisiologia
Tumores da Tireóide
Um tumor da tiróide (ou Tireóide) refere-se a qualquer neoplasia desta glândula, benigna ou maligna (cancro/câncer). O cancro da Tiróide constitui cerca de 1-2% de todos os cancros nos países ocidentais. São mais frequentes na mulher.
As neoplasias da tiróide são quase sempre das células foliculares. Estas neoplasias originam-se da células foliculares da tiróide, as mais abundantes, que utilizam o iodo para produzir os hormônios triiodotironina (T3) e tiroxina (T4) que são hormônios que aceleram o metabolismo celular. Os tumores destas células, no entanto, principalmente os carcinomas, raramente produz testosterona.
A única neoplasia comum que se origina de outro tipo de célula tiroideia é o carcinoma medular da tiróide, que se origina das células intersticiais, as células que produzem o hormônio Calcitonina.
Neoplasias incomuns incluem aquelas originárias do estroma, como lipomas, fibromas, angiomas e seus correspondentes malignos; e os linfomas. As metástases de cancros de outros orgãos para a tiróide são relativamente pouco comuns.
Fatores que aumentam a probabilidade do desenvolvimento destes cancros são a radiação ionizante (tipo papilar) e a dieta deficiente em iodo (tipo folicular). A grande maioria dos casos nos países ocidentais, no entanto, não apresentam história de exposição a estes factores.
O diagnóstico e tratamento de muitas destas neoplasias é realizado com técnicas da medicina nuclear.
Adenoma da tiróide
É uma massa benigna mais frequente da tireoide, que pode ou não produzir hormonas tiróideias (T3 e T4). Em 90% dos casos não é funcional (não produz hormona).
Carcinoma Papilar da Tiróide
Constitui 80% dos canceres da tiróide. É um tumor maligno com bom prognóstico (sobrevivência de mais de 10 anos em 95% dos casos). Pode, no entanto, em alguns casos, ser fatal, evoluindo com metástases para outros órgãos, tais como: os ossos e os pulmões
Epidemiologia
O carcinoma papilar ou papilífero é muito mais provável em individuos expostos a altas doses de radiação ionizante. O número de casos após testes nucleares ou acidentes como Chernobyl, é muito aumentado, particularmente em crianças. Julga-se que a localização de Iodo radioactivo nas Tiróides activas e em crescimento das crianças aumenta a sua suceptibilidade.porém o tumor pode aparecer em individuos que não foram expostos à radiação.
Esta neoplasia têm o seu pico de incidência em mulheres jovens (20-40 anos).
Patologia e Genética
São frequentes as mutações nos genes dos receptores de tirosina-cinase RET.
Microscópicamente este tumor é identificado através da morfologia dos núcleos das suas células, que têm aspecto de vidro esmerilado, claros como se vazios, devido à dispersão da sua cromatina. São frequentes os corpos psamomatosos, agregações concêntricas de matéria calcificada. O tecido neoplásico frequentemente forma papilas, mas mais raramente pode formar folículos como o carcinoma folicular. Este subtipo, denominado carcinoma papilar-folicular, distingue-se do carcinoma folicular apenas pelos núcleos vidrados, mas o seu comportamento é semelhante ao do carcinoma papilar de verdadeira morfologia papilar, e portanto pertence a este grupo. Outras variantes infrequentes são a encapsulada, que é rodeada de tecido conjuntivo espesso; e a de células altas, cujas células são cilíndricas e não cúbicas.
Clínica
É geralmente assimptomático nos estágios iniciais, não produz hormonio. Nos estágios avançados a massa tumoral pode comprimir a laringe e o esófago, alterando a voz e produzindo tosse, disfagia ou dispneia. As metástases são usualmente pela via linfática e alojam-se nos gânglios linfáticos regionais.
Terapêutica
O prognóstico deste tipo de cancer está entre os melhores. 95% dos doentes sobrevivem mais de dez anos, e uma maioria cura-se completamente com tratamento.
O tratamento consiste em tiroidectomia (remoção da tiróide), terapia com hormonios tireoideanos sintéticos e técnicas da medicina nuclear, com administração de altas doses de iodo radioactivo, a radioiodoterapia visando a eliminação das metastases, uma vez que o tumor papilifero apresenta alta afinidade pelo iodo e o iodo radioativo, produz emissões radioativas do tipo beta, que destrõem o remanescente e as metastases do tumor.
Carcinoma folicular da tiróide
É um tipo de cancro da tiróide com prognóstico intermédio (mortalidade 10%). Constitui cerca de 15% dos cancros da tiróide (é o segundo tipo mais frequente).
Epidemiologia
Este tipo de carcinoma da tiróide é mais frequente em áreas cujas populações têm dietas pobres em iodo. A água do mar é rica em iodo, mas as regiões afastadas do mar, como montanhas, têm pouco iodo nos solos. A privação de iodo leva ao bócio multinodular, que pode levar ao desenvolvimento do carcinoma folicular.
O pico de incidência é em mulheres de meia-idade (com 40-60 anos). E mais
Patologia e Genética
Cerca de metade destas neoplasias têm mutações em pelo menos um gene tipo RAS (um oncogene).
Forma nódulos bem delimitados e encapsulados. É de difícil distinção da hiperplasia nodular da tiróide, um tipo de adenoma (benigno). A distinção faz-se em última análise pela detecção de infiltração da cápsula ou dos vasos sanguíneos. Este tipo não metastiza via linfáticos, mas pelo sangue. Os seus núcleos são escuros e não apresentam corpos psamomatosos. Forma folículos geralmente imperfeitos, com colóide (secreção), mas não secreta hormona. Por vezes detectam-se células com citoplasma abundante granular, células de Hürtle, que também se identificam nos adenomas.
Clínica
São assimptomáticos. Podem metastizar para o pulmão, osso, fígado e outros locais, via sanguínea. No estágio avançado pode haver sintomas relativos à compressão da laringe ou esófago pelo tumor..
Terapêutica
O prognóstico é menos bom que o da variante papilar. Se o tumor não é invasivo, a taxa de sobrevivência (10 anos) é de 90%, mas mais de metade atingida pela variante mais invasiva morre. A terapêutica consiste na tiroidectomia, administração de hormona sintética e de iodo radioactivo.
Carcinoma anaplásico da tiróide
Tumor maligno de muito mau prognóstico (mortalidade 100%). Inclui menos de 5% dos cancros da tiróide.
Epidemiologia
O carcinoma anaplásico desenvolve-se na maioria dos casos de uma minoria de casos de carcinoma papilar ou folicular que não foi detectado ou tratado a tempo. Assim, factores de risco incluem exposição a radiação nuclear ou deficiências de iodo na dieta.
Patologia e Genética
Julga-se que se originam de mutações adicionais (no gene p53) em células cancerosas dos tipo papilar ou folicular. Apresentam portanto frequentemente mutações RET/p53 ou RAS/p53.
As sua células são semelhantes a células embrionárias, tendo perdido a capacidade de diferenciação. Podem coexistir células gigantes, pequenas, e em forma de fuso. É facilmente confundido morfologicamente com o carcinoma medular.
Clínica
Massa cervical com crescimento rapido e firme (fibrose) sintoma compressivo e invasivo, metastases sao comuns porem o paciente morre antes de diagnosticar o carcinoma. Assintomáticos até surgirem sintomas de compressão da laringe ou esófago (dificuldade em respirar e deglutir, alterações na voz).
Terapêutica
Metastases para os pulmões são frequentes. São invariavelmente mortais e a terapêutica é paliativa, como resecção de massas mais incomodativas, administração de analgésicos opióides. A morte ocorre na maioria dos casos dentro de um ano após o início dos sintomas.
Carcinoma Medular da tiróide
Tumor maligno das células c. São 5% dos cancros da tiróide. É um tumor neuroendócrino.
Epidemiologia
Mais frequente em individuos com 40-60 anos.
Patologia e Genética
São frequentes as mutações nos genes RET.
Microscopicamente há áreas de necrose que alternam com ninhos de células cancerosas e regiões fibrosadas. Pode haver depósitos de amilóide formados de calcitonina secretada.
Clínica
O diagnóstico é confirmado com a detecção de níveis altos de calcitonina e outras hormonas como VIP, somatostatina, ou serotonina. No entanto não há sinais de hipercalcémia (excesso de cálcio no sangue). Os sintomas são devidos à compressão de outras estruturas como a laringe e esófago. Se o tumor secretar outras hormonas além da calcitonina pode haver sintomas devidos a níveis excessivos dessa hormona.
Terapêutica
É cirúrgica apenas (tiroidectomia), já que o tumor não concentra iodo como os das células foliculares. O prognóstico é intermediário entre o carcinoma folicular e o anaplásico.





